PRUEBAS A LA FLAMA
- Miguel Angel Trujillo Aguilar

- 27 sept 2018
- 4 Min. de lectura
ENSAYOS A LA LLAMA
"En condiciones normales los átomos se encuentran en el estado fundamental, que es el más estable termodinámicamente. Sin embargo, si los calentamos absorbe energía y alcanza así un estado excitado. Este estado posee una energía determinada, que es característica de cada sustancia. Los átomos que se encuentran en un estado excitado tienen tendencia a volver al estado fundamental, que es energéticamente más favorable. Para hacer esto deben perder energía, por ejemplo, en forma de luz. Puesto que los estados excitados posibles son peculiares para cada elemento y el estado fundamental es siempre el mismo, la radiación emitida será también peculiar para cada elemento y por lo tanto podrá ser utilizada para identificarlo. Esta radiación dependerá de la diferencia entre los estados excitados y el fundamental de acuerdo con la ley de Planck:"
AE = hv ;
AE = diferencia de energía entre los estados excitado y fundamental
h = Constante de Planck (6,62 10-34 J s). v= frecuencia
"Por lo tanto, el espectro de emisión puede considerarse como “la huella dactilar” de un elemento. Este hecho se conocía ya desde antiguo, antes aún de entender como ocurría, por lo que los químicos han utilizado los “ensayos a la llama” como un método sencillo de identificación. En la actualidad existen técnicas de análisis basadas en este principio, tales como la espectroscopia de emisión atómica, que nos permiten no sólo identificar, sino cuantificar la presencia de distintos elementos."
EL ORIGEN DE LOS COLORES DE LA LLAMA (ESPECTRO DE EMISION)
Origen de los colores
"El color es un fenómeno físico de la luz o de la visión, asociado con las diferentes longitudes de onda en la zona visible del espectro electromagnético. La percepción del color es un proceso neurofisiológico muy complejo.
La luz visible está formada por vibraciones electromagnéticas cuyas longitudes de onda van de unos 350 a unos 750 nanómetros (milmillonésimas de metro). La luz con longitud de onda de 750 nanómetros se percibe como roja, y la luz con la longitud de onda de 350 nanómetros se percibe como violeta. Las luces de longitudes de onda intermedias se perciben como azul, verde, amarilla o anaranjada."
"Todos los objetos tienen la propiedad de absorber y reflejar o emitir ciertas radiaciones electromagnéticas. La mayoría de los colores que experimentamos normalmente son mezclas de longitudes de onda y reflejan o emiten las demás; estas longitudes de onda reflejadas o emitidas son las que producen sensación de color."
"Los distintos colores de luz tienen en común el ser radiaciones electromagnéticas que se desplazan con la misma velocidad, aproximadamente, 300.000 kilómetros por segundo (velocidad de la luz). Se diferencian en su frecuencia y longitud de onda:"
Frecuencia = Velocidad de la Luz/Longitud de onda
"Dos rayos de luz con la misma longitud de onda tienen la misma frecuencia y el mismo color."
Origen de los colores en la llama del mechero
"Los átomos y los iones están constituidos en su interior, por una parte central muy densa, cargada positivamente, denominada núcleo y por partículas negativas llamadas electrones, los cuales rodean al núcleo a distancias relativamente grandes. De acuerdo a la teoría cuántica, estos electrones ocupan un cierto número de niveles de energía discreta. Resulta evidente, por lo tanto, creer que la transición de un electrón de un nivel a otro debe venir acompañada por la emisión o absorción de una cantidad de energía discreta, cuya magnitud dependerá de la energía de cada uno de los niveles entre los cuales ocurre la transición y, consecuentemente, de la carga nuclear y del número de electrones involucrados."
"En otras palabras, la energía de una transición electrónica es inversamente proporcional a la longitud de onda de la luz emitida o absorbida y directamente proporcional a la frecuencia de radiación. Un espectro atómico está compuesto por una o más longitudes de onda. Debido a que los elementos tienen diferente carga nuclear, diferente tamaño y diferente número de electrones, es razonable concluir que cada elemento está caracterizado por un espectro atómico, el cual es diferente al de cualquier otro elemento. El espectro a la llama de los compuestos de los metales alcalinos es un espectro atómico de emisión y se representan como líneas espectrales discretas."
ENSAYOS A LA LLAMA EN MEZCLAS
"En una mezcla cada elemento exhibe a la llama su propia coloración, independientemente de los demás componentes. Por lo tanto, el color a la llama para una mezcla de elementos estará compuesto por todos los colores de sus componentes. Ciertos colores sin embargo, son más intensos y más brillantes, enmascarando a aquellos de menor intensidad. El color amarillo del sodio, por ejemplo, opacará parcialmente a todos los demás. Por esto un ensayo a la llama ordinario no resulta de mucha utilidad en la identificación de las mezclas. En estos casos es recomendable usar filtros de color, o un espectroscopio. Usualmente, la interferencia del sodio, en una mezcla donde los componentes sean sales de sodio y potasio, puede ser eliminada por medio de un vidrio azul de cobalto, el cual absorbe la luz amarilla pero transmite la luz violeta del potasio. Por medio de ese filtro es posible detectar la llama violeta del potasio aún en presencia del sodio."
EL ESPECTROSCOPIO
"El único método seguro para realizar los ensayos a la llama, es descomponiendo la luz por dispersión e identificando los elementos presentes por sus líneas características. El instrumento utilizado para tal fin es el espectroscopio, el cual es un instrumento que descompone un haz de luz en sus componentes de diferentes colores, usando un prisma y una rejilla."
Bibliografía
Universidad de Alicante, ENSAYOS A LA LLAMA, Accedido el 25 de septiembre, 2018,
desde: https://dqino.ua.es/es/laboratorio-virtual/ensayos-a-la-llama.html
ENSAYOS A LA LLAMA, Accedido el 25 de septiembre, 2018,
desde: http://www.ciens.ucv.ve/eqsol/LabMovil/Recursos/ensayosalallama.pdf
DEPARTAMENTO DE FÍSICA Y QUÍMICA, ENSAYOS A LA LLAMA, Accedido el 25 de septiembre, 2018,
desde: http://iespmbroseta.edu.gva.es/04h_fisica/carpeta_arxius/ENSAYOS%20A%20LA%20LLAMA.pdf


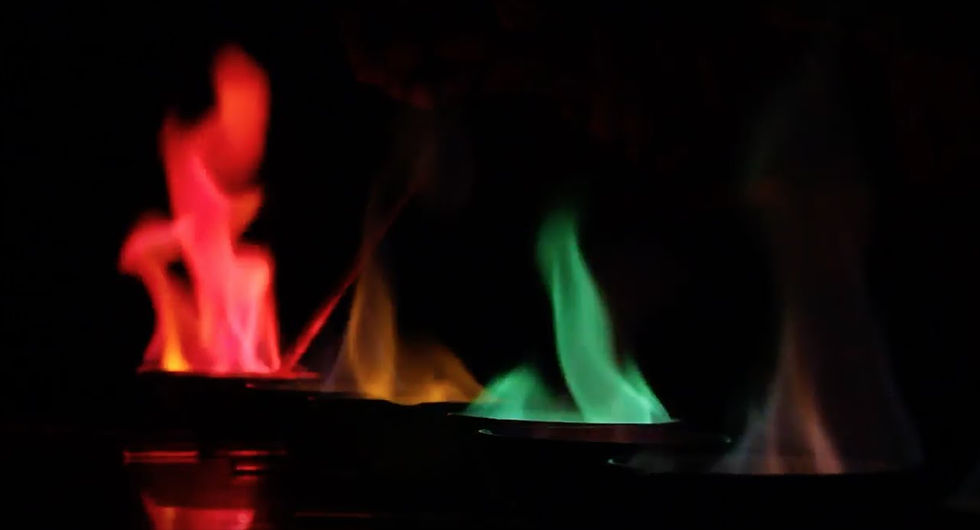



Comentarios